 发布时间:2024-07-29
发布时间:2024-07-29
 来源:
来源:
 浏览量:2117
浏览量:2117
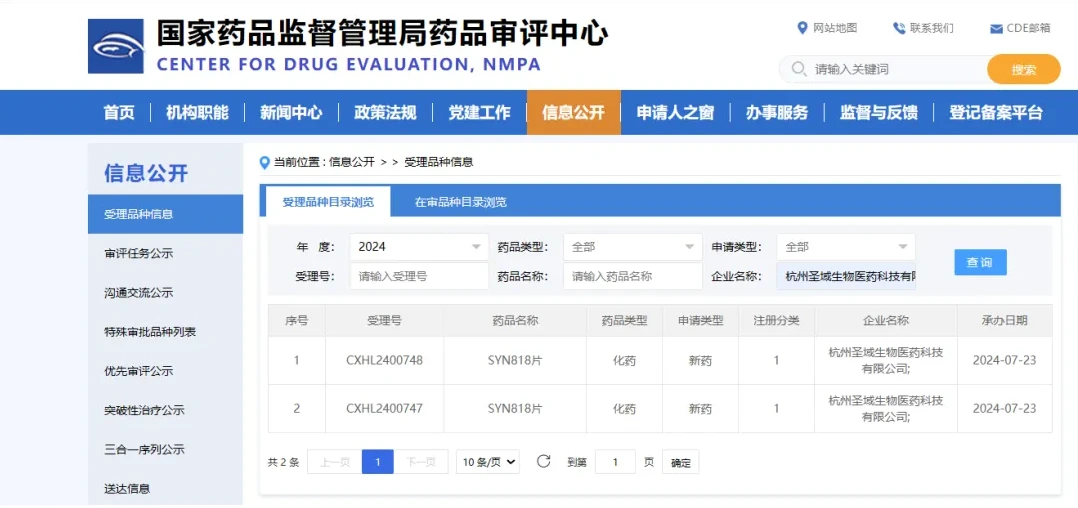
7月24日,圣域生物自主研发的创新药物SYN818片的新药临床试验申请(IND)获得美国FDA的许可,即将启动Ⅰ期临床试验。这是圣域生物首个迈入临床开发阶段的创新药。几日前(7月23日),SYN818片在中国的IND申请也获得国家药监局药品评审中心(CDE)的受理。
对此,圣域生物联合创始人&CEO刘颂博士表示:“此次临床试验申请的获批,标志着我们的新药研发进入了一个新的阶段。我们期待通过临床试验进一步验证新药的安全性和有效性,为肿瘤患者带来新的希望。”
SYN818是由圣域生物自主研发的一款新型小分子抑制剂化合物。该药物通过精准靶向DNA聚合酶θ(Polθ),有效抑制肿瘤细胞的DNA损伤修复,从而有选择性的杀死肿瘤细胞。临床前研究显示,SYN818能够高效抑制Polθ蛋白活性,阻断MMEJ修复通路,与同源重组缺陷(HRD)存在联合致死效果,从而发挥抗肿瘤作用。同时,它在体内外研究中也表现出与PARPi的显著联合增效作用。SYN818在临床前研究中表现出强效抗肿瘤活性、优异的药代动力学性质,以及良好的安全性,未观察到显著的血液毒性。
根据临床前研究数据,SYN818作为一个Polθ抑制剂具有潜在“best-in-class”的特征。SYN818不仅对HRD肿瘤细胞具有单独成药的潜力,还具有与PARP抑制剂、放化疗、抗体偶联药物等联合用于多种肿瘤治疗的潜质,有望降低现有治疗方案的临床毒性、克服耐药,具有广阔的临床开发前景。





